中国团队《Science》发文,首次公开新冠疫苗动物实验研究结果
该实验在小鼠、大鼠和恒河猴身上均取得一致效果。
为了从根本上应对疫情,全球已经有180多种疫苗在如火如荼地进行临床试验,不过一直以来,有关各家疫苗的更多信息并未被公开披露。
5月6日,Science发布了一篇名为《Rapid development of aninactivated vaccine for SARS-CoV-2》(《SARS-CoV-2病毒灭活疫苗的快速开发》)的论文,首次公开了新冠疫苗动物实验研究结果。
该实验结果是北京科兴中维生物技术有限公司(“科兴中维”)正在徐州进行临床试验的“克尔来福”,即我国正在临床试验的三大疫苗之一的部分基础研究。

关于该项动物实验结果
据论文显示,该研究成果主要是为了验证疫苗的安全有效性,而目前研究者在动物身上的试验也收获了好的效果。
据悉,研究者从11名感染了新冠病毒的住院患者(包括5名重症监护患者)的支气管肺泡灌洗液(BALF)中分离出多个新冠病毒毒株(包括CN1、CN2等),其中5株来自国内,3株来自意大利,1例来自瑞士,1例来自英国,1例来自西班牙。这11个毒株广泛散布在基于所有可用序列构建的系统发育树上,在一定程度上代表了正在流行的病毒种群。
在此基础上,研究者选择CN2毒株制备疫苗,开发了一种纯化的灭活新冠病毒候选疫苗,并进行了中试生产。该疫苗在小鼠、大鼠和非人灵长类动物中均可诱导新冠病毒特异性中和抗体产生。这些抗体能有效地中和所选的其他10株(CN1、CN3-CN5和OS1-OS6)具有代表性的新冠病毒毒株,表明它们对世界范围内广泛流行的新冠病毒毒株都可能有潜在的中和能力。
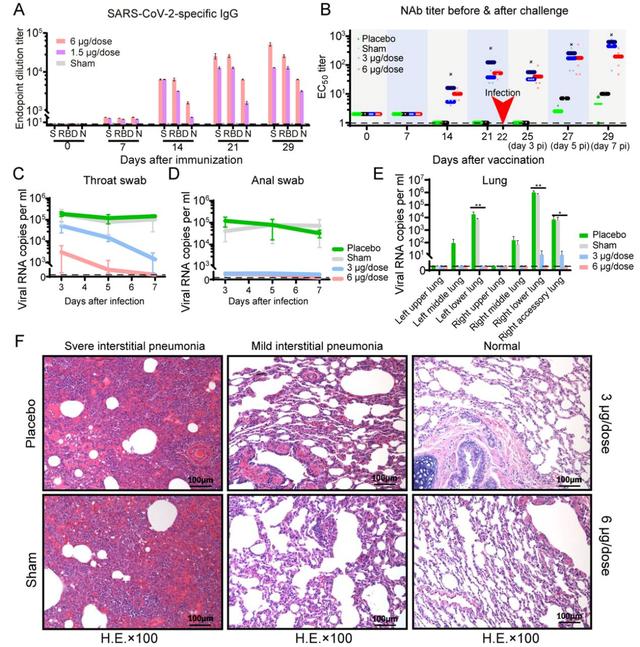
图 | 疫苗在非人灵长类动物中的免疫原性和保护效果
为评价疫苗的免疫原性,研究者在第0天和第7天分别给小鼠接种不同剂量的候选疫苗后,未观察到炎症或其他不良反应,新冠病毒的S蛋白和RBD特异性的免疫球蛋白在免疫后小鼠的血清中迅速产生,并于第6周达到滴度峰值。RBD特异的免疫球蛋白在S蛋白诱导产生的抗体中占一半,提示RBD是主要的免疫原,这也与恢复期患者的血清学特征非常相似。与恢复期患者血清相比,该疫苗诱导出了更高滴度的S蛋白特异性抗体。
接下来,研究者使用微量中和试验测定新冠病毒特异性中和抗体在一段时间内的水平。结果显示,高剂量免疫的中和抗体在初免后第1周出现,在第2周加强免疫后显著增加,在第7周达到峰值,而对照组则未检测到新冠病毒特异性抗体反应。研究者在大鼠中以及对不同毒株的实验中也得到了相似的结果。
随后研究者在疫苗免疫后的恒河猴中进行了攻毒实验以评价疫苗免疫原性和保护效果。研究者在第0、7和14天给恒河猴接种不同剂量(3微克和6微克)的疫苗,结果显示,S蛋白特异性的免疫球蛋白和中和抗体均在第2周被诱导出来,并在第3周继续增加,抗体滴度与恢复期的新冠患者的血清中的抗体滴度相似。
之后,研究者在第22天进行攻毒。结果显示,与对照组相比,疫苗免疫后的恒河猴肺部组织病理变化显著减小,病毒载量也显著下降。高剂量组的4只恒河猴感染后的第7天,咽喉、肛门和肺部都未检测到病毒,也没有观察到抗体依赖的增强现象。中剂量组感染后第7天咽部、肛门和肺部标本中能部分检测到病毒,但与对照组相比病毒载量降低了约95%。结果表明,接种6微克剂量候选疫苗后可以对新冠病毒攻毒提供完全的保护,3微克剂量的疫苗有部分保护作用。
研究者又通过观测临床指标和生化指数来验证该疫苗的安全性。他们发现,所有接种疫苗的恒河猴均未发现发烧和体重减轻现象,且食欲和精神状态都保持正常。在血液和生化分析方面,接种了疫苗的恒河猴的淋巴细胞亚群比例(CD3+、CD4+和CD8+)以及关键细胞因子(TNF-α、IFN-γ、IL-2、IL-4、IL-5和IL-6)与对照组相比均没有显著变化。此外,第29天对接种疫苗恒河猴的肺、心、脾、肝、肾和脑在内的各种器官组织的病理学评估表明,该疫苗也没有引起显著的病理学特征,以上结果表明候选疫苗在恒河猴中具有安全性。
值得一提的是,因为恒河猴非常接近人类,且该研究采用了多种毒株,研究本身具有广泛的参考意义。
该研究由中国医学科学院医学实验动物研究所秦川团队领衔,联合浙江省疾控中心张严峻团队、科兴控股生物技术有限公司、中国科学院生物物理研究所王祥喜团队、中国食品药品检定研究院、中国疾病预防控制中心传染病预防控制所等多家单位合作完成。
进入临床试验的新冠疫苗
目前,全球新冠疫苗的研发推进速度都很快。
如上文提到,现如今已经有180多种疫苗进入了临床试验。其中据张文宏介绍,美国有2个疫苗进入三期临床试验,我国有2个疫苗进入二期临床试验。
基于上述研究成果正在进行临床试验的疫苗“克尔来福”是我国研制的一种灭活疫苗,它用新型冠状病毒(CZ株)接种Vero细胞,经病毒培养、收获、灭活、纯化和铝吸附制成,其主要成分为灭活的新型冠状病毒(SARS-CoV-2),不添加防腐剂和生物保护剂。
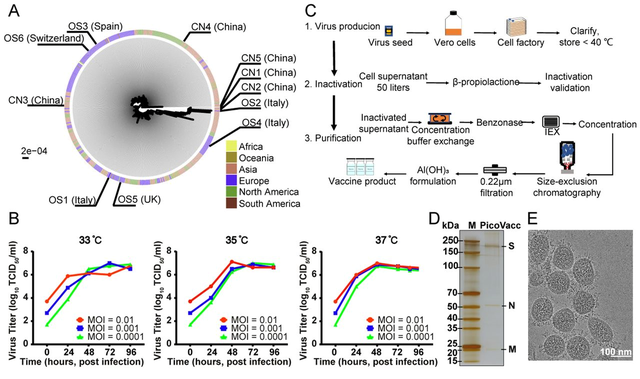
图 | 新冠病毒灭活疫苗的特征描述
1月28日科兴中维正式启动了该疫苗研制项目;3月13日,科兴中维先后向国家药监局药品审评中心(CDE)滚动提交了18轮申报资料,并于4月12日向CDE正式提出临床试验申请;4月16日,它的临床一期试验正式在江苏省徐州市睢宁县启动,共招募144名18至59岁的健康志愿者,分为随机、双盲、安慰剂对照(不含病毒成分的对照疫苗)组三个组别。
当然,不仅如此,我国还有其他两种灭活病毒也同样进入了临床试验,国外进入临床试验的疫苗还包括英国牛津大学研发的腺病毒载体疫苗、美国生物科技公司Moderna研发的mRNA疫苗mRNA-1273、德国生物科技公司BioNTech研发的mRNA疫苗BNT162以及美国Inovio Pharmaceuticals研发的新冠DNA疫苗INO-4800等。
疫苗研发的进度与难点
可以说,目前在科研机构、药厂与监管机构等的协作下,疫苗的学术研究、临床前试验、I/II/III期试验和疫苗批准等阶段几乎都在同步推进,疫苗推出时间也被大幅压缩。
理想状态下,疫苗什么时候能上市?
张文宏指出,按照目前三期临床研究的时间表和中国二期临床研究的时间表,世界上最早的疫苗结果公布时间,应该在今年年底或者明年年初1月左右。如果所有数据理想,能够申报美国FDA或中国CFDA的通过,应该在明年3月到6月之间。
但是他同时表示,我们不应该对疫苗有过高期待。
其实,目前的疫苗研究也确实存在显著的难题。
首先,在研究时间方面,各疫苗研究机构必须争分夺秒,因为一旦疫情受到控制,不具备研究大环境,很多疫苗的三期试验很可能会被迫终止,前期大量的投入也会付诸东流。
此外,虽然广撒网更容易推进疫苗的研发,但疫苗研发的资金投入也是巨大的。谈及此,联合国秘书长古特雷斯也指出,为帮助找到疫苗、新疗法和更好的检测方法而寻求的资金目标,仅仅相当于抗击新冠病毒所需工具的“首付款”。
不过,在欧盟主办的一次会议上,已经有世界领导人、国际组织和银行承诺提供74亿欧元(约536.5亿元)资金,推动新冠疫苗的研究。
当然,困难还不止于此,后期包括招募健康志愿者等以用于临床人体试验,这些都将是巨大的投入。世卫组织的一个工作小组周三(5月6日)在网站发布的报告中称,这种研究会对实验对象构成重大潜在危险,可能会在形势严峻的情况下予以考虑,并进行适当的披露和保护。
总之,如张文宏提到,疫苗虽然能够从根本上解决问题,但因为研发难度大,未来一两年,还是要以防控和病情的救治为止。
最后,记得关注微信公众号:镁客网(im2maker),更多干货在等你!
硬科技产业媒体
关注技术驱动创新
 健康
安全
瑞士
生物
研究院
健康
安全
瑞士
生物
研究院

 微信ID:im2maker
微信ID:im2maker
 长按识别二维码关注
长按识别二维码关注